| 標準工作 |
| 產(chǎn)品認證 |
| 標準制定修訂 |
| 管理辦法 |
| 申請表下載 |
| 認證產(chǎn)品查詢(xún) |
| 保健功能紡織品 |
| 達標產(chǎn)品查詢(xún) |
| 保健功能紡織品 |
| 可追溯二維碼標識 |
| 標識介紹 |
| 標識申請 |
| 聯(lián)系方式 |
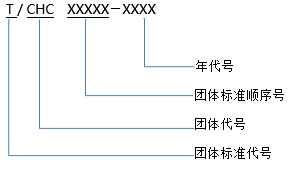
中國保健協(xié)會(huì )團體標準管理辦法(試行)第一章 總 則 第一條 為推動(dòng)我國健康管理與促進(jìn)及其支撐產(chǎn)業(yè)的發(fā)展,提高我國健康管理與促進(jìn)及其支撐產(chǎn)業(yè)標準化事業(yè)的發(fā)展,加強“中國保健協(xié)會(huì )標準”(以下簡(jiǎn)稱(chēng)為:CHC標準)的規范化管理,根據國家相關(guān)規定和中國保健協(xié)會(huì )的章程,制定本辦法。 第二條 本辦法所稱(chēng)健康管理與促進(jìn)及其支撐產(chǎn)業(yè)的范圍包括:健康管理、促進(jìn)、服務(wù),保健食品、保健用品、健身產(chǎn)品、保健器械、特殊用途化妝品及其原料、輔料、包裝材料(直接接觸產(chǎn)品的包裝材料)等。 第三條 CHC標準為自愿性標準。本著(zhù)開(kāi)放、公平、透明、協(xié)商一致的原則,企業(yè)可根據各自的實(shí)際情況參與CHC標準的制修訂工作。 第四條 CHC標準的制修訂工作應當遵循以下原則: (一) 貫徹國家有關(guān)法律、法規和規章; (二) 嚴格執行強制性標準;積極實(shí)施推薦性標準; (三) 保障安全和人體健康,保護環(huán)境、滿(mǎn)足市場(chǎng)需求、保護消費者的利益; (四) 有利于推動(dòng)健康管理與促進(jìn)及其支撐產(chǎn)業(yè)科技發(fā)展,提升科技水平、創(chuàng )新能力,提高產(chǎn)品質(zhì)量; (五) 有利于合理利用資源、能源,推廣科技成果、提高經(jīng)濟效益; (六) 有利于對外經(jīng)濟技術(shù)合作和對外貿易; (七) 積極采用國際標準和國外先進(jìn)標準。 第五條 中國保健協(xié)會(huì )負責CHC標準的立項和批準發(fā)布工作;中國保健協(xié)會(huì )科技發(fā)展部(以下簡(jiǎn)稱(chēng)“行標委”)承擔組織CHC標準立項審查、起草、征求意見(jiàn)、審查、復審、檔案管理等中國保健協(xié)會(huì )交辦的各項工作。 第六條 CHC標準編號由團體標準代號(T/)、團體代號(CHC)、團體標準順序號和年代號組成。
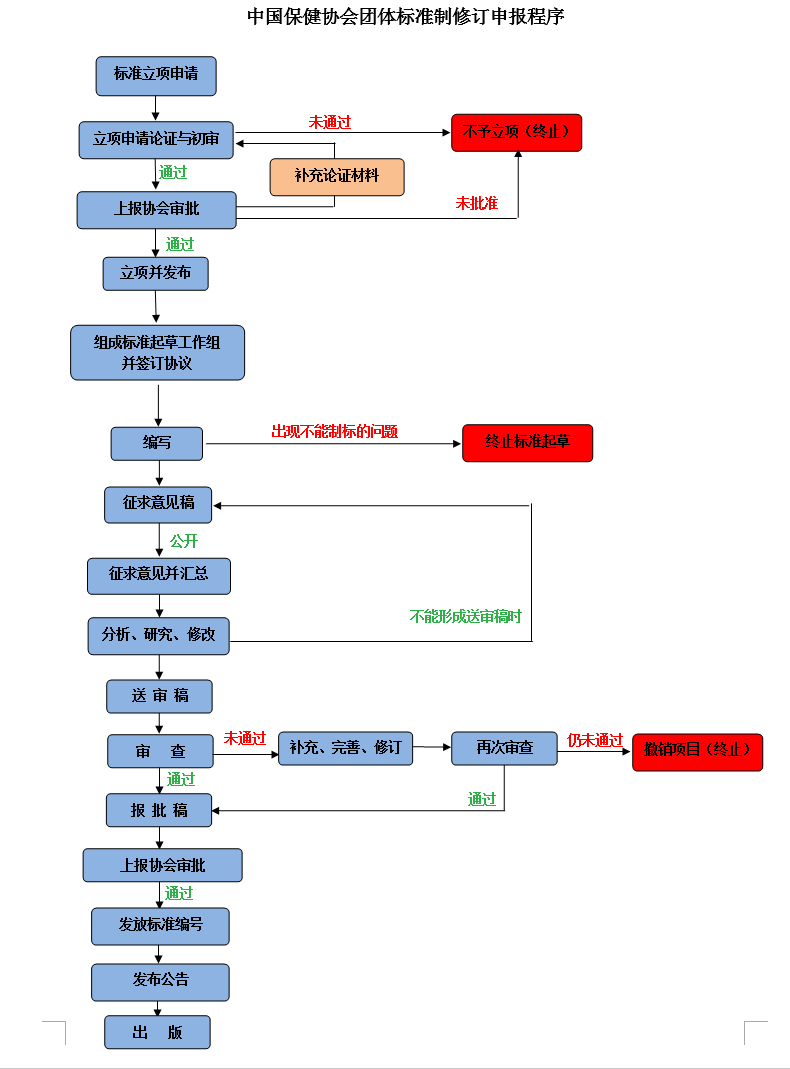
第七條 CHC標準主要以中文編撰;根據需要,部分標準以中文和英文兩種語(yǔ)言編寫(xiě)并出版。發(fā)生異議時(shí),以中文文本為準。 第二章 CHC標準的制修訂程序 第八條 CHC標準的制修訂程序包括:申請、立項、起草、征求意見(jiàn)、審查、通過(guò)和發(fā)布、實(shí)施、復審等。CHC標準制修訂工作中,如申請未通過(guò)或者未進(jìn)行流程前一項程序,則不得進(jìn)行下一程序。
第一節 立 項 第九條 中國保健協(xié)會(huì )會(huì )員企業(yè)及相關(guān)組織可向協(xié)會(huì )提出標準制修訂立項申請,按要求填寫(xiě)“中國保健協(xié)會(huì )團體標準制修訂項目立項申請表”并提供相關(guān)資料,交行標委。申請單位應對申報材料的真實(shí)性負責,并承擔相應的責任。 第十條 參與標準制修訂的單位應當建立資料交接、檔案管理、工作紀律等各項規章制度,按照分工做好職責范圍內的工作,并承擔相應的責任。 第十一條 CHC標準由行標委受理標準立項申請資料后組織對該標準立項申請進(jìn)行論證及初審。 第十二條 如立項申請未通過(guò)論證的,則由行標委向該立項申請人出具“標準制修訂不予立項通知書(shū)”。 第十三條 立項申請經(jīng)過(guò)論證及初審后,上報中國保健協(xié)會(huì )。根據下列情況分別做出處理: (一)獲得協(xié)會(huì )批準的,由協(xié)會(huì )發(fā)文正式立項并發(fā)布立項公告。 (二)如需對立項申請補充論證的,則應當在補充論證資料后,重新申報審議。 (三)如未獲得協(xié)會(huì )批準的,由行標委向立項申請人出具“標準制修訂不予立項通知書(shū)”。 第二節 起 草 第十四條 CHC標準一經(jīng)正式立項,行標委應牽頭確定主要起草單位并組成標準起草工作組,進(jìn)行標準起草準備工作。包括:資料收集、國內外狀況分析、必要的實(shí)驗驗證等起草工作。同時(shí),行標委應與相應起草單位簽訂“CHC標準制修訂協(xié)議書(shū)”,明確各自權利與義務(wù)。 第十五條 標準的編寫(xiě)應符合國家標準的編寫(xiě)規則,參照GB/T 1 《標準化工作導則》、GB/T 20000《標準化工作指南》、GB/T 20001《標準編寫(xiě)規則》的規定及相關(guān)要求執行。 第十六條 標準起草工作組在起草標準草案時(shí),應同時(shí)編寫(xiě)標準編制說(shuō)明,其內容一般包括: (一)工作簡(jiǎn)況,包括任務(wù)來(lái)源、主要工作過(guò)程、主要參加單位和工作組成員及其所作的工作等; (二)標準編制原則; (三)標準主要內容(如:技術(shù)指標、試驗方法、檢驗規則等)的編寫(xiě)理由,解決的主要問(wèn)題,配套的檢測數據,修訂標準時(shí)應列出與原標準的主要差異和水平對比; (四)主要試驗(或驗證)情況的分析、論證和預期達到的經(jīng)濟效果; (五)采用國際標準和國外先進(jìn)標準情況,與國際、國外同類(lèi)標準水平的對比情況,國內外關(guān)鍵指標對比分析; (六)重大分歧意見(jiàn)的處理經(jīng)過(guò)與依據; (七)標準中涉及專(zhuān)利的情況; (八)標準性質(zhì)的建議說(shuō)明(是否首次制定/修訂;是否有廢止相關(guān)標準的建議等); (九)貫徹標準的建議和措施; (十)其他應予說(shuō)明的事項; 第三節 征求意見(jiàn) 第十七條 CHC標準起草工作組完成標準征求意見(jiàn)稿后,應當向使用本標準的生產(chǎn)者、消費者、管理者、研究者等征求意見(jiàn)。征求意見(jiàn)的形式為信函征求意見(jiàn)或者網(wǎng)上公開(kāi)征求意見(jiàn)。征求意見(jiàn)材料應當包括CHC標準征求意見(jiàn)稿、編制說(shuō)明及有關(guān)附件。 第十八條 被征求意見(jiàn)的單位或個(gè)人應當在截止日期前回復意見(jiàn),逾期不回復,按無(wú)異議處理。對比較重大的意見(jiàn),應當說(shuō)明論據或者提出技術(shù)經(jīng)濟論證。征求意見(jiàn)的期限一般為30日。 第十九條 起草工作組應當對征集的意見(jiàn)進(jìn)行歸納整理,分析研究和處理后,對標準征求意見(jiàn)稿進(jìn)行修改,并確定能否提交審查,必要時(shí)可以重新征求意見(jiàn)。 第二十條 起草工作組負責提出CHC標準送審稿、編制說(shuō)明、征求意見(jiàn)匯總處理表及有關(guān)附件,提交會(huì )議審查或進(jìn)行函審。 第四節 審 查 第二十一條 行標委負責組織對CHC標準送審稿進(jìn)行審查,可以采用會(huì )議審查或者函審。CHC標準起草人和中國保健協(xié)會(huì )管理人員不能參加表決。 第二十二條 會(huì )議審查時(shí),應當在會(huì )議前十五天將CHC標準送審稿、編制說(shuō)明、征求意見(jiàn)匯總處理表及有關(guān)附件等提交參加CHC標準審查會(huì )議的單位和人員。 第二十三條 會(huì )議審查表決時(shí),須填寫(xiě)“中國保健協(xié)會(huì )標準送審稿投票單”,必須有不少于出席會(huì )議代表人數的三分之二同意方為通過(guò)。 第二十四條 會(huì )議審查時(shí),應寫(xiě)出“會(huì )議紀要”,并附參加審查會(huì )議單位和人員名單。 第二十五條 函審時(shí),應當在函審表決截止日期前十五天將函審通知和CHC標準送審稿、編制說(shuō)明、征求意見(jiàn)匯總處理表及“中國保健協(xié)會(huì )標準送審稿投票單”提交給相關(guān)單位和人員。函審時(shí),應當寫(xiě)出“函審結論”并附“中國保健協(xié)會(huì )標準送審稿投票單”。有效回函中不少于三分之二同意方為通過(guò)。 第二十六條 會(huì )議審查或者函審沒(méi)有通過(guò)的,起草工作組應當對送審稿進(jìn)行相應的修改后,重新組織審查。 第二十七條 重新審查仍沒(méi)有通過(guò)的,該項目將被撤消。 第二十八條 通過(guò)立項論證的標準項目在制修訂中如出現重大技術(shù)難關(guān),不能制訂成正式標準的,該項目將被終止。 第二十九條 CHC標準中涉及技術(shù)和專(zhuān)利的事項,依照國家法律、法規的相關(guān)規定執行。 第五節 通過(guò)和發(fā)布 第三十條 行標委對CHC標準報批稿、編制說(shuō)明等報批材料進(jìn)行形式審查,內容包括:標準報批材料的完整性、標準編寫(xiě)體例、標準制修訂程序完備性等。不符合標準編寫(xiě)及標準審查有關(guān)規定的,退回起草工作組進(jìn)行修改。 第三十一條 形式審查合格的,由行標委報送中國保健協(xié)會(huì )審查批準。 第三十二條 通過(guò)審查批準的CHC標準,由中國保健協(xié)會(huì )發(fā)放標準編號并發(fā)布公告,同時(shí)刊登在中國保健協(xié)會(huì )官方網(wǎng)站和全國團體標準信息平臺網(wǎng)站上。 第三十三條 制修訂CHC標準過(guò)程中形成的有關(guān)資料,由行標委依據中國保健協(xié)會(huì )檔案管理規定等要求存檔。 第六節 實(shí) 施 第三十四條 CHC標準為自愿性標準,由中國保健協(xié)會(huì )會(huì )員約定采用或者其他有關(guān)單位自愿采用。CHC標準如轉化為地方標準、行業(yè)標準或國家標準的,相應的CHC標準予以廢止。 第七節 復 審 第三十五條 CHC標準實(shí)施后,應當根據實(shí)施的實(shí)際情況和發(fā)展需要,由行標委進(jìn)行復審,復審周期一般不超過(guò)五年。 第三十六條 復審可以采用會(huì )議審查或者函審。會(huì )議審查或者函審時(shí),一般要有參加過(guò)CHC標準審查工作的單位或者人員參加,審查結束時(shí)應當填寫(xiě)復審結論單。CHC標準復審結果按下列情況分別處理: (一)不需要修改的標準,應確認為繼續有效;確認繼續有效的標準不改變順序號和年號。如標準重新出版或加印時(shí),應在該標準封面上,標準編號下寫(xiě)明“XXXX年確認有效”字樣; (二)需要修改的標準作為修訂項目立項,立項程序按本辦法 第二章第一節執行。修訂的標準順序號不變,原年代號改為修訂批準發(fā)布時(shí)的年代號; (三)已無(wú)存在必要的標準,應予以廢止。其廢止的標準號不再用于其它標準的編號。 第三十七條 復審結果應同時(shí)在中國保健協(xié)會(huì )官方網(wǎng)站和全國團體標準信息平臺上公告。
第三章 附 則 第三十八條 CHC標準由中國保健協(xié)會(huì )負責解釋并出版發(fā)行。版權歸中國保健協(xié)會(huì )所有。 第三十九條 本辦法由中國保健協(xié)會(huì )負責解釋。 第四十條 本辦法自發(fā)布之日起施行。
|